1. 분자를 구성하는 성분 원자 그들의 비로 나타낸 화학식은?
① 시성식
② 구조식
③ 실험식
④ 분자식
시성식 : 작용기 표시해 놓은 것(CH2=CH2)
구조식 : 결합선으로 나타내은 분자식(H-H-C=C-H-H)
실험식 : 분자식을 가장 간단한 정수비(CH2)
분자식 : 시성식을 원소갯수대로 묶어 놓은 것(C2H4)
정답은 3번
2. CH4의 질량은 8g이며 mol수와 분자수를 구하시오
① 0.5mol, 3.01x10^23개
② 1mol, 6.02x10^23개
③ 0.6mol, 3.01x10^23개
④ 0.2mol, 2.00x10^23개
CH4의 분자량은 16이므로 0.5몰
정답 1번
3. 원자가전자에 대한 설명으로 틀린것은?
① 최외각전자로 불린다
② s전자, p전자로 구성된다
③ 원자의 화학적 성질을 결정한다
④ 원소의 원자가전자는 변하지 않는다
원자가전자 : 가장 바깥 전자껍질에 있는 전자, 화학적성질을 결정
단, 원자가전자 ≠ 최외각전자(유사하지만 항상 일치하는건 아니다!)
cf) 18족원소 : 비활성기체(Ar, He 등)
원자가전자 : 화학적성질 → 반응성 X → 반응할 수 있는 전자 즉, 원자가전자는 0개
최외각전자 : 8개
원자가전자는 변할 수 있다 전자를 잃으면 양이온, 얻으면 음이온
정답 4번
4. 오비탈 공간배위를 결정하는 것은?
① 주양자수
② 부양자수
③ 자기양자수
④ 스핀양자수
암기법은 자기 (맛집) 방향이랑 위치 알려줘!!
참고(오비탈 암기법_4번) https://chmical.tistory.com/33
자기양자수 - 방향, 위치(궤도면)
주양자수 - 에너지, 크기
부양자수 - 모양(3차원)
스핀양자수 - 전자의 자전방향
정답 1번
5. 3중결합을 가지는 것은?
① F2
② HCN
③ O2
④ CO2
1) F-F
2) H-C≡N
3) O=O
4) O=C=O
이건 간단하게 결합선 외우면 편하다
C : 4, N : 3, O : 2, H/F : 1
정답 2번
6. 1기압 0도 조건에서 메탄을 완전연소하여 물 9g을 얻었을 때, 연소된 메탄의 양(g)은?
① 4
② 6
③ 8
④ 16
CH4 + 2O2 → CO2 + 2H2O
2x = 0.5mol (∵ 물 9g = 0.5mol)
반응한 CH4 몰 수 즉, x = 0.25mol × 16 = 4g
정답은 1번
7. PF5의 결합에 대한 설명으로 옳지 않은 것은?
① 삼각쌍뿔구조이다
② 쌍극자가 없다
③ 비공유전자쌍이 없다
④ 전기음성도가 큰 F로 인해 극성이다
 |
 |
삼각쌍뿔구조이며 대칭구조이므로 비극성이므로 쌍극자가 없다
정답 4번
8. 반데르발스 방정식으로 옳지 않은 것은?
① a(n²/V²)은 분자간 인력에 대한 보정이다
② a, b는 모든 물질에 대해 같은 값이다
③ nb는 분자 자체의 부피에 대한 보정이다
④ 고온, 저압에서 두 보정항은 0에 가까워져 이상기체와 비슷해진다
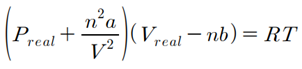
반데르 발스 상수(a, b)는 기체의 종류마다 다른값을 나타낸다
고온, 저압에서 이상기체에 가까워져서 a,b 보정항이 없어져 이상기체 방정식이 된다(PV=nRT)
정답 2번
9. 용액의 총괄성에 대한 특성으로 옳지 않은 것은?
① 끓는점 오름
② 어는점 내림
③ 증기압 오름
④ 삼투압현상
용액의 총괄성은 묽은용액의 성질이며
① 끓는점 오름
② 어는점 내림
③ 증기압 내림
④ 삼투압현상
끓는점만 오름이므로 유의하자!!
정답은 3번
10. 화학반응속도에 관해 특성으로 옳지 않은 것은?
① 농도가 증가하면 충돌횟수가 증가하여 반응속도가 증가한다
② 반응속도는 온도가 증가하면 르샤틀리에 법칙에 의해 발열인지 흡열인지에 따라 달라진다
③ 온도 증가 시, 반응속도 변화는 아레니우스에 근거한다
④ 촉매를 사용하면 화학평형에 관여하여 반응속도가 증가한다
3번 온도가 증가 → 활성화E 이상을 가진 입자 수 증가 → 반응속도 증가
(기체반응에서 10℃정도 증가하면 반응속도는 2~3배 증가)
4번 촉매는 화학평형에는 관여하지 않고, 반응속도만 증가시킨다(단, 정촉매일때만)
cf) 정촉매 : 활성화E 감소 → 반응을 일으킬 수 있는 분자수 증가 → 반응속도 증가
부촉매 : 활성화E 증가, 반응속도 감소
정답 4번
* 참고사항
<반응속도상수(k)>
① (농도) 농도에 무관
② (온도) 온도 높을수록 반응속도상수 증가
③ (촉매여부) 활성화E 낮을수록 반응속도상수 증가
<반응속도(-ra)>
① (농도) 농도클수록 충돌횟수 증가하여 반응속도 증가
② (온도) 10℃정도 증가하면 반응속도는 2~3배 증가
③ (촉매여부) 정촉매일 때, 반응속도 증가
④ (반응물질의 종류) 고 < 액 < 기
⑤ (표면적) 표면적이 클수록 반응속도 빠르다
⑥ (압력) 압력이 증가하면 부피감소하여 농도가 증가하므로 반응속도 증가
11. 다음 중 염기성산화물이 아닌 것은?
① Na2O
② P4O10
③ LiH
④ BaO
염기성산화물은 물에 녹아서 염기성을 나타내는것으로 주로 금속산화물
여기서 1번(Na), 3번(Li), 4번(Ba)는 금속이므로 정답은 2번
① Na2O + H2O → 2NaOH
② P4O10 + 6H2O → 4H3PO4
③ LiH + H2O → Li(OH)2
④ BaO + H2O → Ba(OH)2
정답 3번
자세한 자료를 원하시면 아래를 참고해주세요
https://kmong.com/self-marketing/532464/LshUjjkdwP
화공직 공기업 요약본 - 열역학, 유체역학, 반응공학등 - 크몽
화공이 전문가의 자료·템플릿 서비스를 만나보세요. #구매 전 필독- 해당 교재는 전자책(PDF)로만 제공되며, 실물 책은 제공되지 않습니다....
kmong.com
'공기업 전공 기출문제' 카테고리의 다른 글
| [화공직] 24년 한국가스안전공사 필기 복원-1(24.4.28 시험) (2) | 2024.07.06 |
|---|---|
| [화학직] 20년 중부발전 화공직 전공 복원 -2 (4) | 2024.03.17 |
| [화학직] 20년 중부발전 화공직 전공 복원-1 (0) | 2024.03.05 |
| [화공직] 19년 가스 공기업 화공직 필기 복원 -4 (1) | 2024.01.15 |
| [화공직] 19년 가스 공기업 화공직 필기 복원 -3 (0) | 2024.01.14 |

